PSMAddition: Dodavanje ¹⁷⁷Lu-PSMA standardnoj terapiji u hormonski osetljivoj fazi karcinoma prostate pokazalo se korisnim
PSMAddition: Dodavanje ¹⁷⁷Lu-PSMA standardnoj terapiji u hormonski osetljivoj fazi karcinoma prostate pokazalo se korisnim
Prvo kliničko ispitivanje faze III, pod nazivom PSMAddition, ispitivalo je da li dodavanje radioligandne terapije ¹⁷⁷Lu-PSMA-617 (Pluvicto) standardnom lečenju u ranijoj, hormonski osetljivoj fazi bolesti može efikasnije lečiti metastatski karcinom prostate. U ovoj fazi bolesti standardni terapijski pristup predstavlja kombinacija dva leka: standardna hormonska terapija (androgena deprivaciona terapija, ADT) uz savremeni hormonski blokator (inhibitor signalnog puta androgenog receptora, ARPI). Glavno pitanje na koje je studija nastojala da odgovori (primarni ishod) bilo je da li uvođenje ove treće terapije u ranijoj fazi bolesti može duže držati bolest pod kontrolom u poređenju sa uobičajenim dvokomponentnim pristupom.
Dizajn studije
U studiju je bilo uključeno 1.144 pacijenta iz celog sveta. Svi su imali najmanje jednu metastatsku leziju sa ekspresijom PSMA, ali su i dalje odgovarali na hormonsku terapiju, odnosno još nisu bili u kastraciono-rezistentnoj fazi bolesti. Pacijenti su randomizovani u dve jednake grupe:
- Eksperimentalna grupa (572 muškarca): primila je 6 ciklusa terapije ¹⁷⁷Lu-PSMA u razmacima od 6 nedelja, uz standardnu hormonsku terapiju. Ukupno 86% pacijenata završilo je svih šest ciklusa, dok je više od 93% primilo najmanje četiri ciklusa.
- Kontrolna grupa (572 muškarca): primila je isključivo standardnu hormonsku terapiju (ADT + ARPI, "prema izboru lekara: abirateron, enzalutamid, apalutamid ili darolutamid). Pacijentima iz ove grupe bio je omogućen prelazak na terapiju ¹⁷⁷Lu-PSMA-617 nakon potvrđene radiografske progresije bolesti" (Brooks, 2025), što je na kraju učinilo 16% ispitanika. Ovaj procenat je relativno nizak i verovatno ne utiče na pouzdanost rezultata.
Šta je studija pratila
Primarni ishod bila je takozvano preživljavanje bez radiografske progresije (rPFS), odnosno period do pogoršanja bolesti utvrđenog radiološkim metodama.
Ostali važni ishodi obuhvatali su:
- Ukupno preživljavanje (OS): da li su pacijenti ukupno živeli duže,
- Stopu potpunog i ukupnog odgovora: stepen, odnosno dubinu odgovora tumora na terapiju,
- Vreme do prelaska u kastraciono-rezistentnu fazu: period nakon kojeg bolest prestaje da odgovara na hormonsku terapiju.
Ključni rezultati
Usporeno progresiranje bolesti
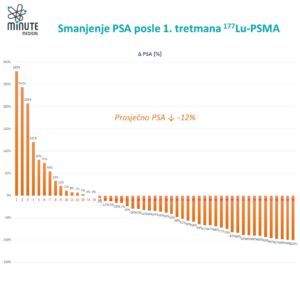
Muškarci u eksperimentalnoj grupi imali su 28% niži rizik od progresije bolesti ili smrti tokom perioda praćenja u poređenju sa kontrolnom grupom. Ovaj rezultat je statistički značajan.
Stopa potpunog odgovora
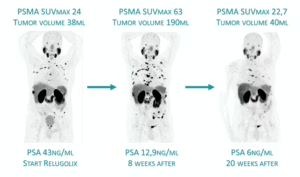
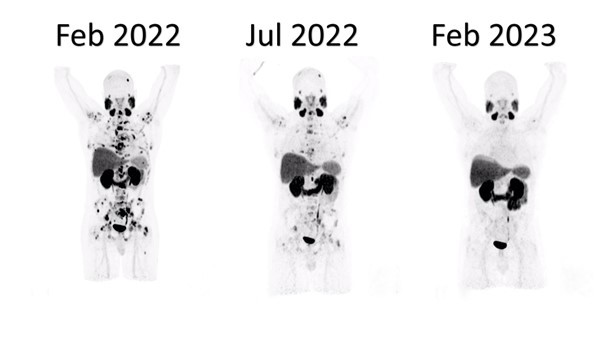
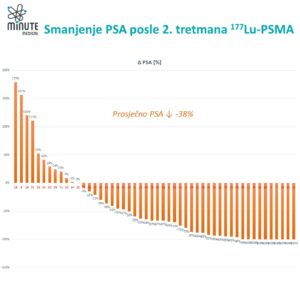
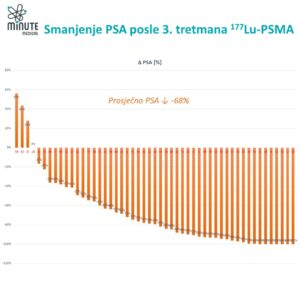
Više pacijenata je postiglo ono što se naziva dubokim odgovorom uz ¹⁷⁷Lu-PSMA. Oko 57% pacijenata u eksperimentalnoj grupi nije imalo vidljivih tumorskih lezija na snimcima, u poređenju sa približno 42% u grupi standardne terapije.
Ukupna stopa odgovora
Otprilike 85% pacijenata koji su primali ¹⁷⁷Lu-PSMA pokazalo je smanjenje ili nestanak tumora, dok je u grupi koja je primala samo standardnu terapiju taj procenat bio oko 81%.
Usporeni prelazak u teško izlečivi rak
Kada rak prostate postane hormonski- ili kastraciono-rezistentan (tj. više ne odgovara na hormonsku terapiju), mogućnosti lečenja su ograničene, a prognoza lošija. Odlaganje ovog prelaska predstavlja značajnu kliničku prednost. Dodavanje ¹⁷⁷Lu-PSMA pacijentima je smanjilo rizik od dostizanja ove rezistentne faze za 30% u bilo kom trenutku tokom studije. Jednostavno rečeno, bolest je ostajala pod kontrolom duže vreme.
Tendencija ka dužem preživljavanju
Rani podaci sugerišu da pacijenti koji su primali ¹⁷⁷Lu-PSMA mogu živeti duže u celini, ali u trenutku izveštaja podaci još nisu bili dovoljno zreli, te je potrebno više vremena da bi se uočile jasne razlike u preživljavanju.
Neželjeni efekti
Dodavanje ¹⁷⁷Lu-PSMA izazvalo je veći broj neželjenih efekata, kao što su umor, suvoća usta, mučnina i promene u krvnoj slici, ali su većina bila kontrolisana.
- Bilo kojeg stepena: 98,4% vs 96,6%
- Stepen ≥3: 51% vs 43%
Diskusija o neželjenim efektima zahteva oprezniji pristup. Postoji mogućnost da su pacijenti u eksperimentalnoj grupi prekomerno lečeni sa 6 ciklusa. Ne treba zanemariti tzv. „efekat ponora tumora“, kada davanje ¹⁷⁷Lu-PSMA pacijentu sa minimalnom ili nikakvom preostalom PSMA-pozitivnom bolešću može biti potencijalno štetno, jer će zdrave tkivne strukture biti izložene višoj dozi zračenja (Rashid K. Sayyid, 2025).
Prethodne studije, poput UpFrontPSMA, pokazale su potpun odgovor već nakon samo 2 ciklusa, što ukazuje na mogućnost da je zračenje iz svih narednih ciklusa uglavnom apsorbovano u zdravim tkivima.
Interim PET skeniranje može biti jednostavno rešenje za ovaj problem: nema ekspresije PSMA → nema potrebe za daljim ciklusima. U našoj klinici MINUTE Medical, je ovaj personalizovani, na PET/CT snimanju zasnovan pristup već deo naše rutinske kliničke prakse i pomaže nam da odredimo broj ciklusa, korišćene radionuklide i primenjenu dozu zračenja.
Zaključak
Dodavanje ¹⁷⁷Lu-PSMA standardnoj dvokomponentnoj terapiji u hormonski osetljivoj fazi metastatskog karcinoma prostate:
- značajno je usporilo progresiju bolesti,
- povećalo šanse za dubok ili vidljiv odgovor tumora,
- odložilo prelazak u agresivniju, rezistentnu fazu bolesti,
- izazvalo je više neželjenih efekata, ali pažljiva kalibracija i personalizacija radioligandne terapije, uz pomoć interim kontrolnih PET skenova, moglo bi pomoći u njihovom smanjenju.
Ova studija dodatno potvrđuje opravdanost ranijeg korišćenja ciljane radioligandne terapije, potencijalno poboljšavajući prognozu kod muškaraca čiji je rak prostate već metastazirao, ali i dalje odgovara na hormonsku terapiju.
Bibliografija
Brooks, M. (28. Oktober 2025). Pluvicto in First-Line Hormone-Sensitive Prostate Cancer? Medscape
ONCOLife. (5. November 2025). Radioligand Therapy Pluvicto Reduces Progression Risk by 28% in mHS Prostate Cancer. Health and Pharma
Rashid K. Sayyid, M. M.–T. (October 2025). ESMO 2025: Discussant – Phase III Trial of [177Lu]Lu-PSMA-617 Combined with ADT + ARPI in Patients with PSMA-Positive Metastatic Hormone-Sensitive Prostate Cancer (PSMAddition). Urotoday
Tagawa, D. S. (19. October 2025). PSMAddition data show Novartis Pluvicto™ delays progression to end-stage prostate cancer. Novartis