Iskorišćavanje Alfa Emitera u Radiofarmaceutskim Preparatima za Lečenje Raka
U neprestanoj borbi protiv raka, oblast radiofarmaciji se pojavila kao moćno oružje, a alfa emiteri poput aktinijuma-225, astata-211 i olova-212 brzo dobijaju na značaju. Ovi izotopi koji emituju alfa čestice revolucioniraju lečenje raka, nudeći ciljanu terapiju sa potencijalom da iskorene maligne ćelije uz minimalno oštećenje okolnog zdravog tkiva.
Alfa emiteri: kratak pregled
Alfa čestice su visokoenergetske, sastavljene od dva protona i dva neutrona. Njihova visoka energija i kratak domet (nekoliko prečnika ćelija) čine ih idealnim za precizno uništavanje ćelija raka. Ove karakteristike im omogućavaju da uzrokuju dvostruki prelom u DNK, što zadaje konačni udarac ćelijama raka, istovremeno minimizirajući kolateralnu štetu na okolnim zdravim ćelijama. Alfa emiteri neće zameniti beta emitere poput lutecijuma, već će ih dopunjavati, kao što ćete videti u primeru 225Ac koji se koristi za lečenje raka prostate.
Aktinijum-225: preciznost u akciji
Aktinijum-225 je na čelu istraživanja alfa emitera za lečenje raka. Sa poluživotom od približno 10 dana, radiofarmaci obeleženi aktinijumom-225 pokazali su izuzetnu efikasnost u lečenju metastatskih karcinoma, posebno raka prostate. Klinička ispitivanja su pokazala značajno smanjenje tumora i produžene stope preživljavanja kod pacijenata sa rakom prostate u poodmakloj fazi.
225Ac-PSMA u lečenju raka prostate
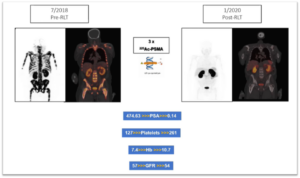
Posebno u slučaju infiltracije koštane srži kod metastatskog raka prostate, alfa emiteri mogu raditi u savršenoj kombinaciji sa lutecijumom. Prva sesija radioligandne terapije sprovedena sa jačim alfa emiterom (npr. 225Ac-PSMA) omogućava uništavanje ćelija raka u koštanoj srži bez oštećenja same srži. Ovo omogućava telu da obnovi svoju funkciju hematopoeze, tj. proizvodnju krvnih ćelija. Studija u Južnoj Africi je bila prva, koja je to demonstrirala. Pacijent sa teškim metastatskim rakom prostate i značajnom difuznom infiltracijom kostiju oporavio se od teške anemije nakon dva tretmana 225Ac-PSMA. Vrednosti hemoglobina i broj trombocita su se dramatično poboljšali, što očigledno vodi ka obnavljanju urođenog imunološkog odgovora tela.
Imamo ustaljenu praksu da našim pacijentima sa odgovarajućim profilom bolesti nudimo kombinovanu terapiju 1 + 2 (jedan tretman 225Ac-PSMA + dva tretmana 177Lu-PSMA).
225Ac-DOTATATE u lečenju NET-ova (neuroendokrinih tumora) i meningioma
Lečenje raka prostate radiofarmaceuticima sada se smatra već etabliranim praksom zahvaljujući dobro utvrđenoj efikasnosti. U međuvremenu, svestranost aktinijuma-225 omogućava mu da bude konjugovan sa različitim drugim molekulama, proširujući njegove potencijalne primene na druge vrste raka, kao što su neuroendokrini tumori (NET-ovi) i meningiomi.
Korišćenje 177Lu-DOTATATE (sa beta-emiterom) u lečenju NET-ova zapravo prethodi upotrebi 177Lu-PSMA za terapiju raka prostate. Međutim, tumori ponekad mogu postati rezistentni na terapije radijacijom nižeg LET (linearni transfer energije), poput onih koje koriste beta emiteri. Dodatno, neki agresivni ili napredni vrste možda neće adekvatno reagovati na terapije koje koriste beta emiteri. U takvim slučajevima, alfa emiteri bolje se pokazuju zbog svoje veće citotoksičnosti.
Otkriće receptora DOTATATE na površine ćelija meningioma, prevalentne vrste tumora mozga, bio je još jedan vrlo nedavni proboj. Imajući u vidu složenu prirodu mozga, gde kritične strukture čvrsto obavijaju tumore, precizno usmeravanje na tumor uz minimalnu izloženost zračenju zdravog moždanog tkiva postaje ključno za ublažavanje nuspojava. Alfa emiteri, sa svojom visoko koncentrisanom ali ograničenom snagom, predstavljaju idealan izbor.
225Ac-DOTATATE dostupan je u našoj klinici.
Astatin-211: novi pristup
Astatin-211 je još jedan obećavajući alfa emiter, karakterisan svojim povoljnim poluživotom (7,2 sata) i snažnim alfa emisijama. Njegov kratki poluživot osigurava da radioaktivna raspada pretežno nastaje unutar tumora, minimizirajući dugotrajno izlaganje pacijenta radijaciji.
Astatin-211 se istražuje u lečenju glioma, vrste tumora mozga sa ograničenim opcijama lečenja. Naučnici su razvili monoklonska antitela obeležena astatinom-211, koja specifično ciljaju antigene povezane sa tumorima. Klinička ispitivanja u ranoj fazi ukazuju da ovaj pristup može dostaviti visoku dozu zračenja direktno u tumor dok štedi normalno tkivo mozga, pružajući nadu za poboljšane ishode kod pacijenata sa gliomom.
Olovo-212: terapija dvostrukog modusa
Olovo-212 se ističe zbog svojih jedinstvenih svojstava raspada, pošto emituje i alfa i beta čestice. Ova dvostruko zračenje može biti korisno u određenim terapijskim kontekstima. Alfa čestice pružaju visokoenergetsku citotoksičnost kratkog dometa, dok beta čestice nude širi opseg, potencijalno ciljajući mikrometastaze.
212Pb-DOTAMTATE nedavno je dobio oznaku "probojne terapije" od strane američke Uprava za hranu i lekove (FDA) za lečenje pacijenata sa gastroenteropankreatičkim neuroendokrinim tumorima (GEP - NET-ovi), koji izražavaju SSTR, u poodmakloj fazi. Ova "oznaka 212Pb-DOTAMTATE, peptida koji cilja SSTR, obeleženog olovom-212, koji generiše alfa čestice, podržana je fazom 1 i trenutno aktivnim fazom 2 kliničkih ispitivanja (NCT05153772).”[2]
Olovo-212 se takođe ispituje za upotrebu u lečenju karcinoma jajnika. Radiofarmaceutik 212Pb-TCMC-trastuzumab cilja HER2 receptor, prekomerno izražen u nekim karcinomima jajnika. Predkliničke studije su pokazale da ovaj spoj može efikasno smanjiti tumor i poboljšati preživljavanje u životinjskim modelima. Klinička ispitivanja radi procene sigurnosti i efikasnosti kod ljudi su u toku.
Upravljanje toksičnošću
Iako alfa emiteri nude precizno ciljanje, njihova visoka energija takođe može predstavljati rizik ako nije adekvatno kontrolisana. Na primer, u lečenju raka prostate, previše 225Ac-PSMA često oštećuje pljuvačne žlezde (one takođe izražavaju enzime PSMA baš kao i ćelije raka prostate), izazivajući tešku kserostomiju (suvoću u ustima), pri čemu se neželjeni efekti nadmašuju koristj. Jedan početni tretman 225Ac-PSMA često je već dovoljan da izazove željeni efekat, uz očuvanje pljuvačnih žlezda.
Budućnost alfa emitera u terapiji raka
Budućnost alfa emitera u terapiji raka izgleda obećavajuće, sa kontinuiranim istraživanjima i kliničkim ispitivanjima koji otvaraju put ka novim paradigama lečenja. Integracija naprednih tehnika slikanja, poput PET i SPECT, omogućava praćenje distribucije radiofarmaceutika i terapijskog odgovora u realnom vremenu. Ova povratna informacija može se koristiti za prilagođavanje planova lečenja i poboljšanje ishoda.
Pored toga, istražuju se personalizovani pristupi medicini, gde se specifične genetske i molekularne karakteristike tumora pacijenta koriste za prilagođavanje radiofarmaceutske terapije. Ovaj pristup personalizovanoj medicini ima potencijal da dodatno poboljša efikasnost i bezbednost terapija alfa emiterima.
Zaključak
Alfa emiteri poput aktinijuma-225, astata-211 i olova-212 predstavljaju značajan napredak u oblasti radiofarmaceutike za lečenje raka. Njihova sposobnost da isporuče tačno ciljane smrtonosne doze zračenja ćelijama raka pruža moćno oružje u borbi protiv maligniteta. Dok istraživanja napreduju i izazovi se rešavaju, ovi radiofarmaceutici koji emituju alfa čestice obećavaju da će poboljšati preživljavanje i kvalitet života pacijenata obolelih od raka širom sveta.
[1] [225Ac]Ac-PSMA-617 α-radioligand therapy of patients with extensive skeletal metastases of castration-resistant prostate cancer, Sathekge et al. 2022
[2] "FDA Grants Breakthrough Therapy Designation to Novel Agent in GEP-NETs"
Bibliography:
Matthew R. Griffiths, David A. Pattison, Melissa Latter, Kevin Kuan, Stephen Taylor, William Tieu, Thomas Kryza, Danielle Meyrick, Boon Quan Lee, Aaron Hansen, Stephen E. Rose, Simon G. Puttick First-in-Human 212Pb-PSMA–Targeted α-Therapy SPECT/CT Imaging in a Patient with Metastatic Castration-Resistant Prostate Cancer Journal of Nuclear Medicine Feb 2024, jnumed.123.267189; DOI: 10.2967/jnumed.123.267189
Albertsson P, Bäck T, Bergmark K, Hallqvist A, Johansson M, Aneheim E, Lindegren S, Timperanza C, Smerud K, Palm S. Astatine-211 based radionuclide therapy: Current clinical trial landscape. Front Med (Lausanne). 2023 Jan 6;9:1076210. doi: 10.3389/fmed.2022.1076210. PMID: 36687417; PMCID: PMC9859440.
Lawal IO, Morgenstern A, Vorster M, Knoesen O, Mahapane J, Hlongwa KN, Maserumule LC, Ndlovu H, Reed JD, Popoola GO, Mokoala KMG, Mdlophane A, Bruchertseifer F, Sathekge MM. Hematologic toxicity profile and efficacy of [225Ac]Ac-PSMA-617 α-radioligand therapy of patients with extensive skeletal metastases of castration-resistant prostate cancer. Eur J Nucl Med Mol Imaging. 2022 Aug;49(10):3581-3592. doi: 10.1007/s00259-022-05778-w. Epub 2022 Apr 6. PMID: 35384462.
Metebi A, Kauffman N, Xu L, Singh SK, Nayback C, Fan J, Johnson N, Diemer J, Grimm T, Zamiara M, Zinn KR. Pb-214/Bi-214-TCMC-Trastuzumab inhibited growth of ovarian cancer in preclinical mouse models. Front Chem. 2024 Jan 25;11:1322773. doi: 10.3389/fchem.2023.1322773. PMID: 38333550; PMCID: PMC10850308.
Video “Alpha is More Than Just Ac-225: Pb-212” JNM Podcast. Ken Herrmann, MD; David Bauer, PhD, from Memorial Sloan Kettering Cancer Center; Jane Sosabowski, BSc, MSc, PhD, from Queen Mary, University of London; Nick Fletcher, PhD, from the University of Queensland, Australia.
Demirci E, Alan Selçuk N, Beydağı G, Ocak M, Toklu T, Akçay K, Kabasakal L. Initial Findings on the Use of [225Ac]Ac-DOTATATE Therapy as a Theranostic Application in Patients with Neuroendocrine Tumors. Mol Imaging Radionucl Ther. 2023 Oct 20;32(3):226-232. doi: 10.4274/mirt.galenos.2023.38258. PMID: 37870290; PMCID: PMC10600558.
Stallons TAR, Saidi A, Tworowska I, Delpassand ES, Torgue JJ. Preclinical Investigation of 212Pb-DOTAMTATE for Peptide Receptor Radionuclide Therapy in a Neuroendocrine Tumor Model. Mol Cancer Ther. 2019 May;18(5):1012-1021. doi: 10.1158/1535-7163.MCT-18-1103. Epub 2019 Mar 29. PMID: 30926632; PMCID: PMC6497546.
Sabrina Serani, February 12, 2024, FDA Grants Breakthrough Therapy Designation to Novel Agent in GEP-NETs, retrieved 03.06.2024 from https://www.targetedonc.com/view/fda-grants-breakthrough-therapy-designation-to-novel-agent-in-gep-nets