Aprovechando emisores alfa en radiofármacologia para el tratamiento del cáncer
Aprovechando emisores alfa en radiofármacologia para el tratamiento del cáncer
En la constante evolución de la batalla contra el cáncer, el campo de la radiofármacologia ha surgido como un arma potente, y los emisores alfa, como el actinio-225, el astato-211 y el plomo-212, están ganando prominencia rápidamente. Estos isótopos emisores de alfa están revolucionando el tratamiento del cáncer, ofreciendo una terapia dirigida con el potencial de erradicar las células malignas mientras se minimiza el daño al tejido sano circundante.
Emisores Alfa: Una Breve Reseña
Las partículas alfa estan compuesto de dos protones y dos neutrones y son altamente energéticas. Su alta energía y corto alcance (unos pocos diámetros celulares) las hacen ideales para destruir células cancerosas con precisión. Estas características les permiten causar una rotura de doble cadena en el ADN, lo que asesta un golpe mortal a las células cancerosas, al mismo tiempo que se minimiza el daño colateral a las células sanas alrededor. Los emisores alfa no reemplazarán a los emisores beta como el lutecio, pero los complementarán, como se verá a continuación en el ejemplo del 225Ac empleado en el tratamiento del cáncer de próstata.
Actinio-225: Precisión en Acción
El actinio-225 está a la vanguardia de la investigación de emisores alfa para el tratamiento del cáncer. Con una vida media de aproximadamente 10 días, los radiofármacos marcados con actinio-225 han demostrado una eficacia notable en el tratamiento de cánceres metastásicos, particularmente el cáncer de próstata. Los ensayos clínicos han demostrado una reducción significativa de tumores y tasas de supervivencia prolongadas en pacientes con cáncer de próstata avanzado.
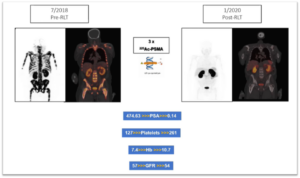
225Ac-PSMA en el tratamiento del cáncer de próstata
Especialmente en casos de infiltración de médula ósea por cáncer de próstata metastásico, los emisores alfa pueden funcionar en perfecta combinación con el lutecio. La primera sesión de terapia con radioligandos realizada con un emisor alfa más potente (por ejemplo, 225Ac-PSMA) permite destruir las células cancerosas en la médula ósea sin afectar la médula en sí. Esto permite que el cuerpo recupere su función de hematopoyesis, es decir, la producción de células sanguíneas. El estudio en Sudáfrica fue el primero en demostrarlo. Un paciente con cáncer de próstata metastásico severo e infiltración ósea difusa grave se recuperó de una anemia severa después de 2 sesiónes de 225Ac-PSMA. Los valores de hemoglobina y el recuento de plaquetas mejoraron drásticamente, lo que obviamente conduce a la revitalización de la respuesta inmune innata del cuerpo.
Tenemos una práctica establecida de ofrecer a nuestros pacientes con un perfil de enfermedad correspondiente una terapia combinada de 1 + 2 (una sesión de 225Ac-PSMA y dos sesiónes de 177Lu-PSMA).
225Ac-DOTATATE en el tratamiento de TNEs y meningiomas
El tratamiento del cáncer de próstata con radiofármacos ahora se considera “una fruta al alcance de la mano” por asi decirlo debido a su eficacia bien establecida. Mientras tanto, la versatilidad del actinio-225 le permite ser conjugado con varias otras moléculas, ampliando sus aplicaciones potenciales a otros tipos de cáncer, como los tumores neuroendocrinos (TNEs) y los meningiomas.
El uso de 177Lu-DOTATATE (con emisor beta lutecio-177) en el tratamiento de TNEs, de hecho, precede al uso de 177Lu-PSMA para la terapia del cáncer de próstata. Sin embargo, a veces los tumores pueden volverse resistentes a las terapias de radiación de baja TLE (Transferencia Lineal de Energía), como aquellas que utilizan emisores beta. Además, algunas formas agresivas o avanzadas pueden no responder adecuadamente a las terapias con emisores beta. En tales casos, los emisores alfa tienen un mejor desempeño debido a su mayor citotoxicidad.
La identificación de receptores de DOTATATE en la superficie de las células de meningioma, un tipo prevalente de tumor cerebral, ha sido otro avance muy reciente. Dada la naturaleza intrincada del cerebro, donde las estructuras críticas envuelven estrechamente los tumores, la precisa focalización del tumor con una mínima exposición a la radiación del tejido cerebral sano se vuelve fundamental para mitigar los efectos secundarios. Los emisores alfa, con su poder altamente concentrado pero limitado el el espacio, son una elección ideal.
El 225Ac-DOTATATE está disponible en nuestra clínica.
Astato-211: Un Enfoque Novedoso
El Astato-211 es otro emisor alfa prometedor, caracterizado por su favorable vida media (7.2 horas) y emisiones alfa potentes. Su corta vida media asegura que la desintegración radioactiva ocurra principalmente dentro del tumor, minimizando asi la exposición a la radiación a largo plazo para el paciente.
El Astato-211 se está explorando en el tratamiento de los gliomas, un tipo de cáncer cerebral con opciones de tratamiento limitadas. Los investigadores han desarrollado anticuerpos monoclonales marcados con Astato-211 que se dirigen específicamente a antígenos asociados al tumor. Los ensayos clínicos en fase inicial indican que este enfoque puede administrar una alta dosis de radiación al tumor sin afectar el tejido cerebral normal, ofreciendo esperanza para mejorar los resultados para los pacientes con gliomas.
Plomo-212: Una Terapia de Doble Modo
El Plomo-212 se destaca debido a sus propiedades únicas de desintegración, emitiendo tanto partículas alfa como beta. Esta emisión de doble modo puede ser ventajosa en ciertos contextos terapéuticos. Las partículas alfa proporcionan citotoxicidad de alta energía y corto alcance, mientras que las partículas beta ofrecen un rango más extendido, potencialmente dirigido a micro-metástasis.
El 212Pb-DOTAMTATE ha sido recientemente designado como "terapia innovadora" por la FDA (Administración de Alimentos y Medicamentos de EE:UU.) para el tratamiento de pacientes con tumores neuroendocrinos gastroenteropancreáticos (TNEs-GEP) avanzados que expresan SSTR. Esta "designación de 212Pb-DOTAMTATE, un péptido dirigido a SSTR completo radiomarcado con plomo-212 que genera partículas alfa, está respaldada por ensayos clínicos de fase 1 y 2 en curso (NCT05153772).”[2]
El Plomo-212 también se investiga para usar en el tratamiento del cáncer de ovario. El radiofármaco 212Pb-TCMC-trastuzumab se dirige al receptor HER2, sobreexpresado en algunos cánceres de ovario. Estudios preclínicos han demostrado que este compuesto puede reducir eficazmente la carga tumoral y mejorar la supervivencia en modelos animales. Se están llevando a cabo ensayos clínicos para evaluar su seguridad y eficacia en humanos.
Gestionando Toxicidad
Si bien los emisores alfa ofrecen un enfoque preciso, su alta energía también puede plantear riesgos si no se controlan adecuadamente. Por ejemplo, en el tratamiento del cáncer de próstata, un exceso de 225Ac-PSMA tiende a dañar las glándulas salivales (que también expresan las enzimas PSMA, al igual que las células cancerosas del cancer de próstata), lo que causa una xerostomía severa (sequedad bucal) con efectos secundarios que superan los beneficios. A menudo, un ciclo inicial de 225Ac-PSMA ya es suficiente para lograr el efecto deseado preservando al mismo tiempo las glándulas salivales.
El Futuro de los Emisores Alfa en la Terapia del Cáncer
El futuro de los emisores alfa en la terapia del cáncer parece prometedor, con investigaciones en curso y ensayos clínicos que allanan el camino para nuevos paradigmas de tratamiento. La integración de técnicas avanzadas de imagen, como TEP y SPECT, permite el monitoreo en tiempo real de la distribución del radiofármaco y la respuesta terapéutica. Esta retroalimentación puede utilizarse para ajustar los planes de tratamiento y mejorar los resultados.
Además, se están explorando enfoques de medicina personalizada, donde las características genéticas y moleculares específicas del tumor de un paciente se utilizan para adaptar la terapia con radiofármacos. Este enfoque de medicina de precisión tiene el potencial de mejorar aún más la eficacia y la seguridad de las terapias con emisores alfa.
Conclusión
Los emisores alfa como el actinio-225, el astato-211 y el plomo-212 representan un avance significativo en el campo de la radiofármacologia para el tratamiento del cáncer. Su capacidad para administrar dosis de radiación altamente enfocadas y letales a las células cancerosas ofrece una herramienta poderosa en la lucha contra las malignidades. A medida que avanza la investigación y se abordan los desafíos, estos radiofármacos con emisores alfa prometen mejorar la supervivencia y la calidad de vida de los pacientes con cáncer en todo el mundo.
[1] [225Ac]Ac-PSMA-617 α-radioligand therapy of patients with extensive skeletal metastases of castration-resistant prostate cancer, Sathekge et al. 2022
[2] "FDA Grants Breakthrough Therapy Designation to Novel Agent in GEP-NETs"
La bibliografía:
Matthew R. Griffiths, David A. Pattison, Melissa Latter, Kevin Kuan, Stephen Taylor, William Tieu, Thomas Kryza, Danielle Meyrick, Boon Quan Lee, Aaron Hansen, Stephen E. Rose, Simon G. Puttick First-in-Human 212Pb-PSMA–Targeted α-Therapy SPECT/CT Imaging in a Patient with Metastatic Castration-Resistant Prostate Cancer Journal of Nuclear Medicine Feb 2024, jnumed.123.267189; DOI: 10.2967/jnumed.123.267189
Albertsson P, Bäck T, Bergmark K, Hallqvist A, Johansson M, Aneheim E, Lindegren S, Timperanza C, Smerud K, Palm S. Astatine-211 based radionuclide therapy: Current clinical trial landscape. Front Med (Lausanne). 2023 Jan 6;9:1076210. doi: 10.3389/fmed.2022.1076210. PMID: 36687417; PMCID: PMC9859440.
Lawal IO, Morgenstern A, Vorster M, Knoesen O, Mahapane J, Hlongwa KN, Maserumule LC, Ndlovu H, Reed JD, Popoola GO, Mokoala KMG, Mdlophane A, Bruchertseifer F, Sathekge MM. Hematologic toxicity profile and efficacy of [225Ac]Ac-PSMA-617 α-radioligand therapy of patients with extensive skeletal metastases of castration-resistant prostate cancer. Eur J Nucl Med Mol Imaging. 2022 Aug;49(10):3581-3592. doi: 10.1007/s00259-022-05778-w. Epub 2022 Apr 6. PMID: 35384462.
Metebi A, Kauffman N, Xu L, Singh SK, Nayback C, Fan J, Johnson N, Diemer J, Grimm T, Zamiara M, Zinn KR. Pb-214/Bi-214-TCMC-Trastuzumab inhibited growth of ovarian cancer in preclinical mouse models. Front Chem. 2024 Jan 25;11:1322773. doi: 10.3389/fchem.2023.1322773. PMID: 38333550; PMCID: PMC10850308.
Video “Alpha is More Than Just Ac-225: Pb-212” JNM Podcast. Ken Herrmann, MD; David Bauer, PhD, from Memorial Sloan Kettering Cancer Center; Jane Sosabowski, BSc, MSc, PhD, from Queen Mary, University of London; Nick Fletcher, PhD, from the University of Queensland, Australia.
Demirci E, Alan Selçuk N, Beydağı G, Ocak M, Toklu T, Akçay K, Kabasakal L. Initial Findings on the Use of [225Ac]Ac-DOTATATE Therapy as a Theranostic Application in Patients with Neuroendocrine Tumors. Mol Imaging Radionucl Ther. 2023 Oct 20;32(3):226-232. doi: 10.4274/mirt.galenos.2023.38258. PMID: 37870290; PMCID: PMC10600558.
Stallons TAR, Saidi A, Tworowska I, Delpassand ES, Torgue JJ. Preclinical Investigation of 212Pb-DOTAMTATE for Peptide Receptor Radionuclide Therapy in a Neuroendocrine Tumor Model. Mol Cancer Ther. 2019 May;18(5):1012-1021. doi: 10.1158/1535-7163.MCT-18-1103. Epub 2019 Mar 29. PMID: 30926632; PMCID: PMC6497546.
Sabrina Serani, February 12, 2024, FDA Grants Breakthrough Therapy Designation to Novel Agent in GEP-NETs, retrieved 03.06.2024 from https://www.targetedonc.com/view/fda-grants-breakthrough-therapy-designation-to-novel-agent-in-gep-nets