TheraP estudio comparando Lu-PSMA con quimioterapia
Estudio TheraP compara la terapia con radioligandos 177Lu-PSMA-617 con la quimioterapia con cabazitaxel en tratamiento del cáncer de próstata
TheraP, un estudio de fase II que comparó el tratamiento con radioligandos 177Lu-PSMA-617 con la quimioterapia con cabazitaxel, se finalizó demostrando una clara ventaja de 177Lu-PSMA sobre la quimioterapia.
Criterios de selección de participantes
200 hombres con mCRPC, en su mayoría pretratados con terapia de privación de andrógeno (91%), fueron seleccionados basado en 68Ga-PSMA PET/TC y 18F-FDG PET/TC. 68Ga-PSMA PET/TC debía detectar la suficiencia de PSMA (min Valor de Captación Estándar o SUV >20) en el tumor y las metástasis, un requisito previo para la terapia con radioligandos; de lo contrario, los radioligandos no tienen dónde acoplarse para decirlo sencillamente. 18F-FDG PET/TC muestra el metabolismo de la glucosa del tumor y sus metástasis: el metabolismo alto indica la agresividad del cáncer. También se excluyeron los pacientes con lesiones con imágenes discordantes de 68Ga-PSMA PET/TC y 18F-FDG PET/TC, es decir, lesiones agresivas con PSMA insuficiente. Después de la asignación aleatoria, 98 hombres fueron asignados a 177Lu-PSMA-617 (6·0–8·5 GBq por vía intravenosa cada 6 semanas con un máximo de seis ciclos), y 85 – a cabazitaxel (20 mg/m² por vía intravenosa cada 3 semanas con un máximo de diez ciclos).
Hallazgos
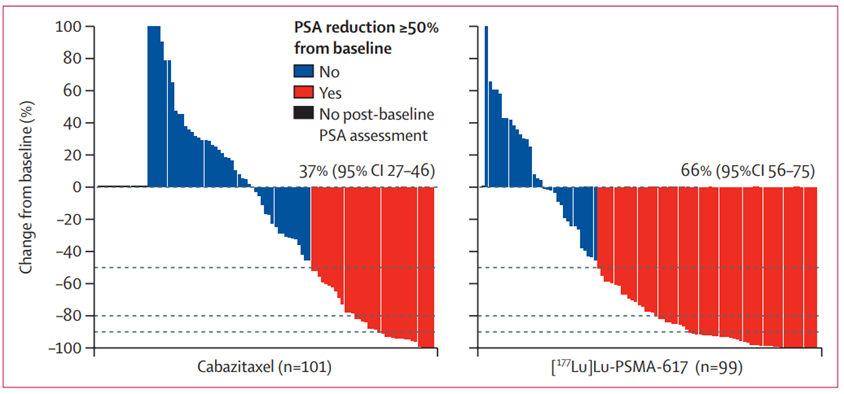
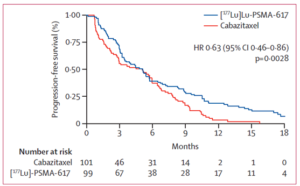
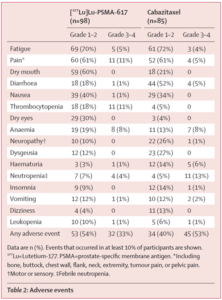 |
Los eventos adversos de grado 3-4 ocurrieron en 32 (33%) de 98 hombres en el grupo 177Lu-PSMA-617 versus 45 (53%) de 85 hombres en el grupo de cabazitaxel. |
Reflexión
Este estudio proporciona datos complementarios al estudio VISION porque el cabazitaxel no se había incluido en el grupo de tratamiento estándar en el estudio VISION. Ambos estudios utilizaron ⁶⁸Ga-PSMA-11 para la selección de pacientes, con TheraP utilizando un parámetro cuantitativo adicional de PET (captación o SUVmax) y ¹⁸F-FDG para identificar pacientes con lesiones discordantes ¹⁸F-FDG-positivas, PSMA-negativas.
Cabe señalar que el cáncer de próstata entre los participantes estaba realmente avanzado: el 85% tenía más de 20 lesiones metastásicas. El perfil de eficacia y seguridad de 177Lu-PSMA-617 demostrado en todos los ensayos hasta ahora ha generado interés en explorar el uso de 177Lu-PSMA más temprano en el curso de la enfermedad. Se están llevando a cabo múltiples ensayos que combinan 177Lu-PSMA con inhibidores del punto de control inmunitario, inhibidor de la poli-(ADP-ribosa)-polimerasa o enzalutamida. También se está explorando el uso de 177Lu-PSMA enseguida en hombres con cáncer de próstata metastásico sensible a las hormonas recién diagnosticado.
La posibilidad de seleccionar a los pacientes que tienen más probabilidades de beneficiarse de la terapia con 177Lu-PSMA es una ventaja clave del enfoque teranóstico, que combina las modalidades de imagen y terapia.
Bibliografía (fuente de todas las tablas)
Hofman M., Louise Emmett L., Sandhu S., Iravani A., Joshua A., Goh J., et al. [177Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. The Lancet 397, issue 10276, P797-804, February 27, 2021 https://doi.org/10.1016/S0140-6736(21)00237-3