TheraP-Studie vergleicht die Therapie mit Radioliganden 177Lu-PSMA-617 und die Chemotherapie mit Cabazitaxel
TheraP, eine Phase-II-Studie, in der die Therapie mit Radioliganden 177Lu-PSMA-617 und die Chemotherapie unter Verwendung von Cabazitaxel verglichen wurden, wurde mit einem klaren Vorteil der 177Lu-PSMA gegenüber der Chemotherapie abgeschlossen.
Auswahlkriterien der Probanden
200 Männer mit mCRPC, überwiegend mit Androgenrezeptor-gerichteten Therapien (ARDT) vorbehandelt (91%), wurden anhand von 68Ga-PSMA PET/CT und 18F-FDG PET/CT ausgewählt. 68Ga-PSMA PET/CT sollte die Suffizienz von PSMA (min Standardized Uptake Value >20) im Tumor und in Metastasen nachweisen, eine Voraussetzung für die Radioligandentherapie; andernfalls haben die Radioliganden sich nirgendwo anzudocken, um es einfach auszudrücken. 18F-FDG PET/CT zeigt den Glukosestoffwechsel des Tumors und seine Metastasen: Ein hoher Stoffwechsel signalisiert die Aggressivität von Krebs. Patienten mit Läsionen mit diskordanten 68Ga-PSMA PET/CT- und 18F-FDG PET/CT-Bildern, d.h. aggressiven Läsionen mit unzureichenden PSMA, wurden ebenfalls ausgeschlossen. Nach dem Zufallsprinzip wurden 98 Männer 177Lu-PSMA-617 (6·0–8·5 GBq intravenös alle 6 Wochen für bis zu sechs Zyklen) und 85 – Cabazitaxel (20 mg/m² intravenös alle 3 Wochen für bis zu zehn Zyklen) zugeteilt.
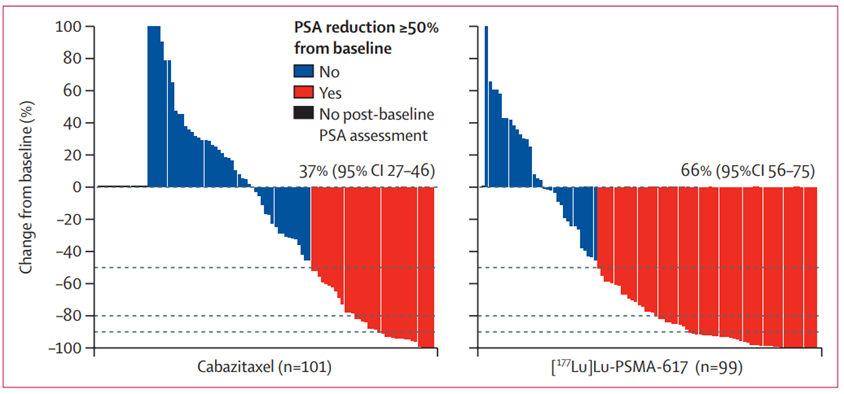
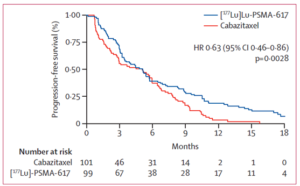
Ergebnisse
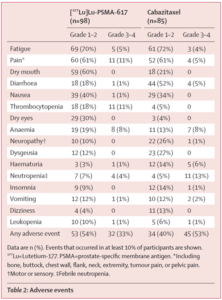 |
Unerwünschte Nebenwirkungen des Schweregrades 3–4 traten bei 32 (33 %) von 98 Männern in der 177Lu-PSMA-617-Gruppe gegenüber 45 (53%) von 85 Männern in der Cabazitaxel-Gruppe auf. |
Diskussion
Diese Studie liefert ergänzende Daten zur VISION-Studie, da Cabazitaxel in der VISION-Studie nicht in die Gruppe unter der besten Standardtherapie aufgenommen wurde. Beide Studien verwendeten ⁶⁸Ga-PSMA-11 für die Patientenauswahl, wobei TheraP einen zusätzlichen quantitativen PET-Parameter (Aufnahme SUVmax) und ¹⁸F-FDG verwendete, um Patienten mit diskordanten ¹⁸F-FDG-positiven, PSMA-negativen Läsionen zu identifizieren.
Es sollte beachtet werden, dass es sich um Probanden mit wirklich fortgeschrittenem Prostatakrebs handelte - 85% hatten über 20 Metastasen. Das Wirksamkeits- und Sicherheitsprofil von 177Lu-PSMA-617, das in allen bisherigen Studien nachgewiesen wurde, hat Forschungsinteresse an der Einsetzung von 177Lu-PSMA zu einem früheren Zeitpunkt im Krankheitsverlauf geweckt. Mehrere Studien sind im Gange, darunter 177Lu-PSMA in Kombination mit Immuncheckpoint-Inhibitoren, einem Poly (ADPribose) -Polymerase-Inhibitor oder Enzalutamid. Die Anwendung von 177Lu-PSMA im Vorfeld bei Männern mit erst diagnostiziertem metastasierendem hormonsensitivem Prostatakrebs wird ebenfalls untersucht.
Die Möglichkeit, Patienten auszuwählen, die am ehesten von der 177Lu-PSMA-Therapie profitieren, ist ein wesentlicher Vorteil des theranostischen Ansatzes, nämlich der Kombination von Bildgebungs- und Therapiemodalitäten.
Bibliographie (Quelle aller Tabellen)
Hofman M., Louise Emmett L., Sandhu S., Iravani A., Joshua A., Goh J., et al. [177Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. The Lancet 397, issue 10276, P797-804, February 27, 2021 https://doi.org/10.1016/S0140-6736(21)00237-3