Knochenmetastasen, Prostatakrebs und Theranostik
Knochenmetastasen sind aufgrund der einzigartigen Mikroumgebung im Knochen häufige sekundäre Tumoren vieler Krebsarten wie Brust- (70%), Prostata- (85%), Lungen- und Nierenkrebs (40%). Krebs metastasiert meist ins axiale Skelett (d.h. Knochen des Rumpfes und des Beckens) und nicht ins appendikuläre Skelett (Gliedmaßen und Schulter- und Hüftgürtel) entlang der Verbreitung des roten Knochenmarks.
Warum Knochen?
Dieses stark vaskularisierte Gewebe enthält blutbildende Stammzellen und eine aktive Mikroumgebung, die das Zellwachstum fördert. Der Prozess ist noch nicht vollständig verstanden, aber die Knochenumgebung ist voll von Wachstumsfaktoren, die die Krebszellen so zu sagen kapern und zu ihrem eigenen Vorteil ausnutzen. Der gesunde Knochen durchläuft einen ständigen Umbauprozess, bei dem Knochenabbau (Resorption) und Knochenneubildung perfekt ausbalanciert sind. Dementsprechend ist die Knochenumgebung auch eine reiche Quelle von Kalzium, die als Folge der ständigen Knochenzerstörung freigesetzt wird. Krebszellen exprimieren (weisen auf) Kalzium-Sensor-Rezeptoren, und diese konstante Versorgung mit Kalzium scheint einen fruchtbaren Boden für das Tumorwachstum zu bieten. Die einzigartige Immunumgebung im Knochen mit ihren vielfältigen hemmenden und stimulierenden Effekten auf Zellen könnte auch zur Proliferation von Metastasen führen. Es kann ebenso sein, dass der langsame Blutfluss im roten Knochenmark die Anheftung von Krebszellen an die Knochenoberfläche erleichtert.
Darüber hinaus wurde bei osteoblastischen Metastasen-Phänotypen (mehr dazu weiter unten) die Fähigkeit von Krebszellen zur Osteomimikry nachgewiesen, d.h. die Fähigkeit von Krebszellen, sich durch die Expression knochenspezifischer Proteine als Knochen zu tarnen. Der Körper verwechselt sie mit gesunden Knochenzellen und "ernährt" sie, anstatt sie zu töten.
Die Metastasierung beginnt früh, noch bevor der Primärtumor klinisch nachweisbar wird, und kann jahrelang ruhen. Die Signale, die schließlich die Tumorzellen "aufwachen" lassen, sind noch wenig verstanden und werden intensiv erforscht. Interaktionen zwischen mehreren Zellen in der Mikroumgebung des Knochens, die die Ruhephase aufrechterhalten und ihr anschließendes Aufwachen verhindern, sind derzeit das Ziel der klinischen Forschung.
Phänotypen der Metastasen
Knochenmetastasen können entweder solche sein, die neue, übermäßige Knochenbildung auslösen (osteoblastisch) oder solche, die die gesunde Knochenmasse zerstören (osteolytisch), oder gemischt. Die meisten Metastasen sind gemischt und zeigen Anzeichen beider Arten, wobei jedoch eine vorherrscht. Brustkrebs neigt zu osteolytischen Knochenmetastasen. Prostatakrebs ist einzigartig in seiner Fähigkeit, abnormale neue Knochenbildung, d.h. osteoblastischen Typ, zu stimulieren. Lungenkrebs-Knochenmetastasen sind tendenziell osteolytisch.
Diagnostik der Knochenmetastasen
Knochenmetastasen werden oft in einem fortgeschrittenen Stadium diagnostiziert, wobei Knochenläsionen bereits recht signifikant sind. Hauptsymptome sind schlecht zu lokalisierende Knochenschmerzen, die sich nachts oft verschlimmern; pathologische Frakturen, Hyperkalzämie (übermäßiger Kalziumspiegel im Blut) und Rückenmarkskompression; Das Blutbild kann Anämie, Thrombozytopenie (niedrige Blutplättchenzahl) oder Leukopenie (niedrige Leukozytenzahl) zeigen. Eine rechtzeitige und präzise Diagnose der Knochenmetastasen ist aufgrund der klinischen Folgen von entscheidender Bedeutung.
Standart-Bildgebungsmethoden wie Röntgen, CT-Scan und Radionuklid-Knochenszintigraphie werden routinemäßig für die Diagnose verwendet. Diese Methoden stellen jedoch hauptsächlich die Reaktion des umgebenden Gewebes auf das Vorhandensein von Krebszellen dar. Biomarker in Blut und Urin spiegeln die laufenden Raten der Knochenresorption und -bildung im Körper als Ganzes wider und liefern keine spezifischen Informationen über die einzelnen Knochenläsionsstellen.
Die Bewertung der Wirkung von Behandlungen ist ebenso wichtig für die klinischen Entscheidungen. Knochen ist die einzige metastatische Stelle mit anders lautenden Kriterien für die Beurteilung des Ansprechens auf die Behandlung, die eher auf Knochenreparatur und -zerstörung als auf Veränderungen des Tumorvolumens basieren. Auch Standard-Bildgebungsverfahren sind für die Behandlungsbewertung nicht sehr geeignet. Es gibt ein inzwischen anerkanntes "Flare“- oder Aufflackern-Phänomen, wenn die erste Reaktion auf die Therapie eine Verschlechterung ist. Diese anfängliche Verschlechterung, die durch die konventionellen bildgebenden Verfahren festgestellt wird, führt häufig zu einer falschen Beurteilung der Unwirksamkeit der Behandlung und folglich zu einem vorzeitigen Abbruch der Behandlung, während auf eine solche anfängliche Verschlechterung tatsächlich eine nachfolgende Verbesserung folgt.
PSMA-Radioligandentherapie mit Lutetium in Behandlung des Prostatakarzinoms
Nachweis der Überexpression von PSMA (Prostata-spezifisches Membranantigen) auf der Oberfläche von Prostatakrebszellen war in der Tat revolutionär in der Behandlung von metastasierendem Prostatakrebs (mPC). Die Theranostik, auf mPC angewendet, kombiniert einen bildgebenden Biomarker (PSMA-PET/KT mit Fluor-18 oder Gallium-68), um die Tumorherde unabhängig von ihrer Lokalisation (Weich- oder Knochengewebe) zu erkennen und darzustellen und dadurch das Ansprechen auf die Behandlung vorherzusagen, und ein weiteres Radioligand (markiert mit Lutetium-177 oder Actinium-225), um die Krebszellen direkt anzupeilen und zu zerstören. PSMA-PET/KT ist auch das bisher präziseste Instrument zur Bewertung der Behandlung. Lesen Sie mehr über die Diagnostik und Therapie auf unserer Website.
Therapieansprechbeispiel nach 3 Sitzungen von Radioligandentherapie mit Lutetium-177 und 4-Wochen Abstand dazwischen
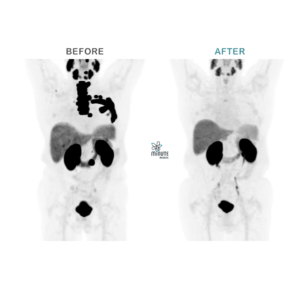
VORHER
PSMA-PET/CT Januar 2021
PSA 77 ng/ml
Metastasiertes kastrationsresistentes Prostatakarzinom nach mehreren antihormonellen Behandlungen (1. & 2. Generation) und Immuntherapie
NACHHER
PSMA-PET/CT Dezember 2021
PSA 0,05 ng/ml
Nach 3x 177Lutetium-PSMA-Ligandentherapie Januar bis März 2021 und keine weiteren Therapien danach
Bibliographie: Coleman, R.E., Croucher, P.I., Padhani, A.R. et al. Bone metastases. Nat Rev Dis Primers 6, 83 (2020). https://doi.org/10.1038/s41572-020-00216-3