Nukleartheranostik: Was kommt als nächstes?
Während die Theranostik das Gesamtüberleben und die Lebensqualität von NET- und Prostatakrebspatienten immens verbessert hat und zunehmend zum festen Bestandteil wird, arbeitet die Wissenschaft unermüdlich an der nächsten großen Sache – der krebsartübergreifenden Theranostik auf Basis des Fibroblasten-Aktivierungs-Proteins (FAP), das in den krebsassoziierten Fibroblasten (CAF) vorkommt. Für die Behandlung vieler häufig vorkommender Krebsarten wäre dies wirklich revolutionär. First-in-Human (Erstanwendung am Menschen) PET/CT-Studien mit 68Ga-FAPI haben hervorragende Ergebnisse gezeigt. Ein für die therapeutischen Zwecke besser geeignetes Ligandenderivat ist in Reichweite.
Was sind krebsassoziierte Fibroblasten (CAFs)?
Tumormassen enthalten Krebszellen, aber auch Gefäße, Entzündungszellen, Kollagen und Fibroblasten (der häufigste Zelltyp im Bindegewebe), die zusammen das Tumor-Stroma bilden. Das Stroma kann bei solchen Karzinomen bis zu 90% der Masse ausmachen. Mehrere häufig vorkommende Krebsarten, wie Brust-, Dickdarm- und Bauchspeicheldrüsenkarzinome, zeichnen sich durch ein starkes Bindegewebswachstum, insbesondere im Umfeld der Tumorzellen, aus. Es wurde nachgewiesen, dass diese krebsassoziierten Fibroblasten (CAFs) ein sogenanntes Fibroblasten-Aktivierungsprotein (FAP) exprimieren. Seine Expression in normalen, ausgereiften Geweben ist nicht vorhanden oder niedrig.
Die Rolle von CAFs im Krebswachstum
CAFs, insbesondere die Subtypen, die das FAP exprimieren, sollen nicht nur Krebszellen physisch unterstützen, sondern auch das Krebswachstum, die Invasion und die Resistenz gegen die körpereigene Immunantwort sowie gegen Bestrahlung und Chemotherapie fördern. Sie sind die Hauptakteure in der Fähigkeit des Tumors, neue Blutzellen zu bilden (Angiogenese) und seine Versorgung mit Nährstoffen sicherzustellen. CAFs produzieren mehrere Wachstumsfaktoren, die zu Tumorbildung, Proliferation und Metastasierung führen (wie vaskulärer endothelialer Wachstumsfaktor (VEGF) oder Fibroblastenwachstumsfaktor (FGF)).[i]
| Daher stellt FAP eine ideale krebsartübergreifende Zielstruktur für die Bildgebung und gezielte Verabreichung von Therapeutika dar. Es erschließt neue Anwendungen für die nicht-invasive Tumorvisualisierung, Tumorstadieneinteilung (Staging) und gezielte Radioligandentherapie für viele Krebsarten, die noch nicht durch nukleare Theranostik abgedeckt worden sind und durch andere Therapien nur unzureichend behandelt werden können. Tatsächlich profitieren neben Schilddrüsenkrebs derzeit Prostatakrebs und neuroendokrine Tumoren vorwiegend von diesem Therapiekonzept. "FAP als Zielstruktur zur Zerstörung von Stroma-CAFs kann die krebsunterstützenden Funktionen unterbinden und das Krebswachstum hemmen. Darüber hinaus kann durch das Durchbrechen der Stromabarriere die Wirksamkeit anderer pharmakologischer, immunologischer, strahlen- oder zellbasierter systemischer Therapien erhöht werden."[ii]
So viel zum „Schloss“. Die Herausforderung besteht darin, einen geeigneten „Schlüssel“ zu entwickeln. |
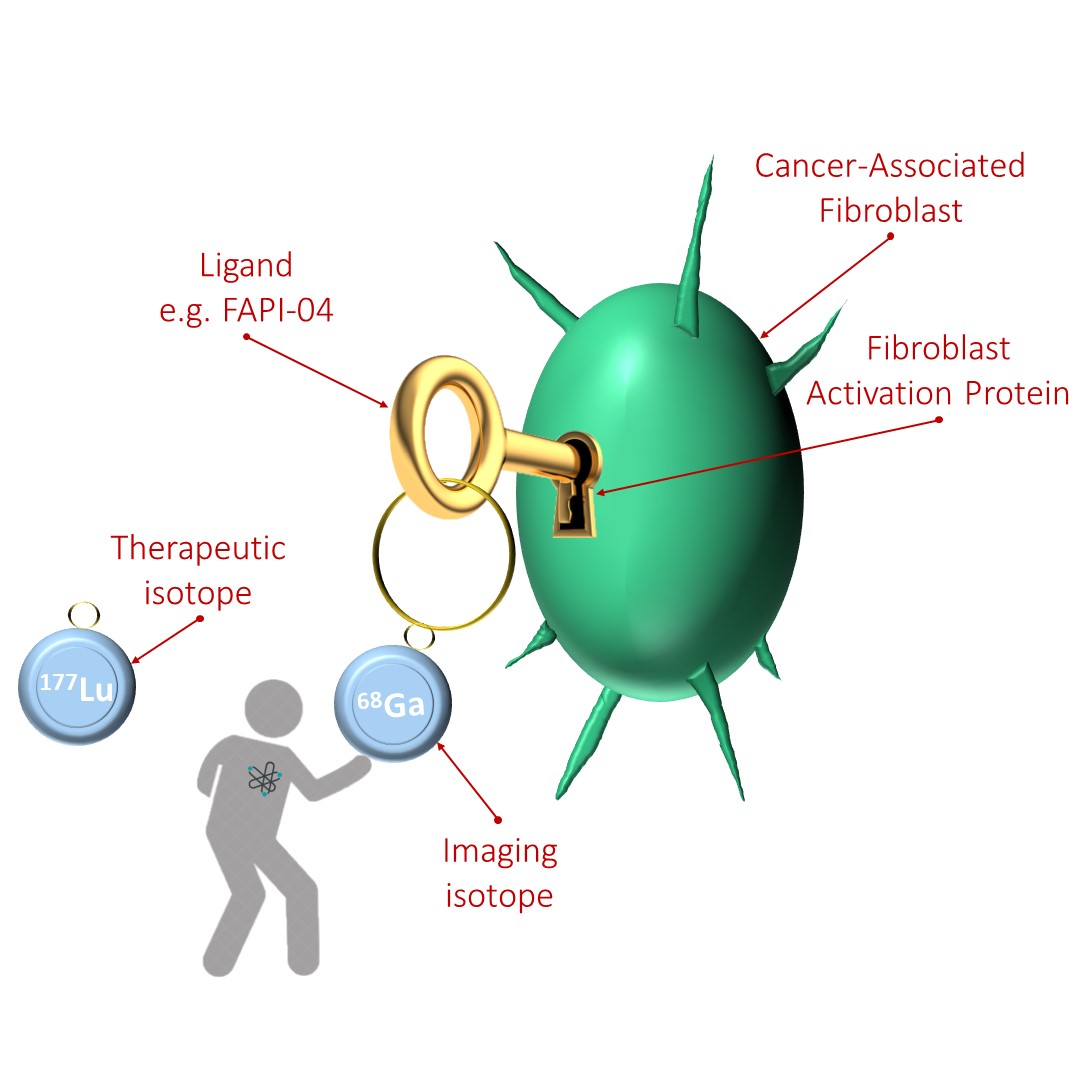 |
Liganden
FAP-spezifische Inhibitoren wurden erstmals in den frühen 2000er Jahren als Krebsmedikamente wie Sibrotuzumab oder Talabostat entwickelt. Inhibitor-basierte Radiopharmaka sind der nächste Schritt. Wissenschaftler arbeiten intensiv an der Entwicklung eines theranostischen Liganden, der sowohl in der Diagnostik als auch in der Therapie eingesetzt werden kann; das heißt, mit einem bildgebenden bzw. therapeutischen Isotop (z. B. Gallium-68 [68Ga] bzw. Lutetium-177 [177Lu]) markiert werden, bei der Injektion an FAP andocken und dort lange genug bleiben, um den gewünschten Effekt zu erzielen.
Bildgebung
|
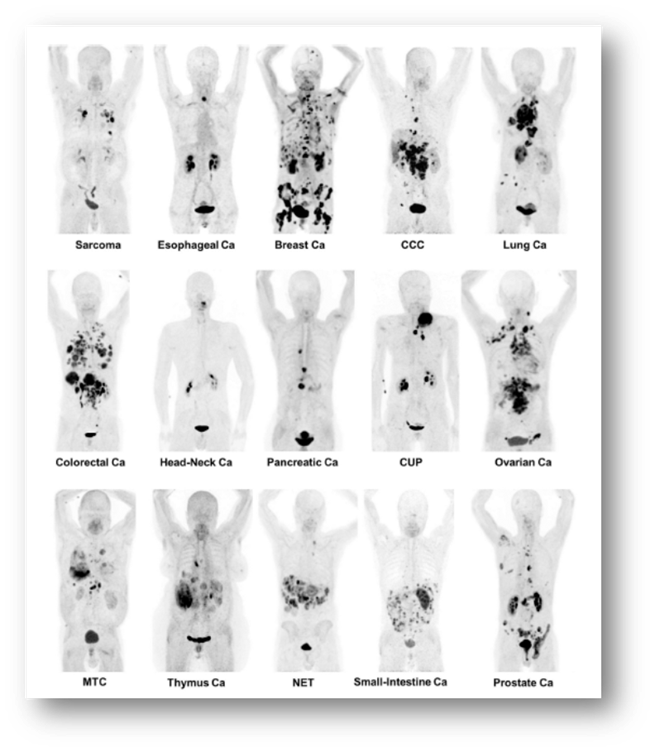
Die Universität Heidelberg hat vor Kurzem einen Chinolin-basierten FAP-Inhibitor (FAPI) entwickelt, um die Radiomarkierung zu ermöglichen. Erste Humanstudien mit 68Ga-FAPI-04 zeigten eine hohe Aufnahme im Tumor und eine geringe Aufnahme in den umliegenden gesunden Geweben (sogenanntes Tumor-zu-Hintergrund-Verhältnis), was zu einer kontrastreichen Tumorbildgebung bei verschiedenen Krebsarten führte. Alle Patienten vertragen die Untersuchung sehr gut, es wurden keine pharmakologischen oder physiologischen Reaktionen beobachtet, keine Symptome berichtet.
Im Vergleich zum 18F-FDG PET/CT, das aktuell vornehmlich für die onkologische Stadieneinteilung verwendet wird, zeichnet sich 68Ga-FAPI PET/CT durch folgende Vorteile ab, und zwar:
|
Radioligandentherapie
Während die Aufnahmerate des Radiopharmazeutikums durch Tumorzellen für diagnostische Zwecke wichtig ist, wird die Verweildauer (Retentionszeit) des Radiopharmakons in Fibroblasten entscheidend für die therapeutischen Zwecke. Das strahlende Nuklid muss lange genug in der Zelle verweilen, damit es eine ausreichende Wirkung erzielt, also die Zelle zerstört. FAPI-04 „wäscht“ relativ schnell aus dem Tumorgewebe aus und reduziert daher die erzielte Strahlendosis der gängigen therapeutischen Strahler wie Lutetium oder Actinium. Alternativ "muss die physikalische Halbwertszeit des therapeutischen Isotops an die Tumorretentionszeit angepasst werden".[ii]
Beschränkungen
Trotz des hervorragenden Kontrastes von FAPI im Tumor-Hintergrund-Verhältnis, von Blut über Leber über Muskeln bis zu Darm, ist die FAP-Exprimierung nicht ausschließlich krebsspezifisch. Es zeigt sich auch in einigen nicht-krebsbefallenen Geweben, wann immer Fibroblasten aktiviert werden, zum Beispiel "bei Umbauprozessen wie Wundheilung, Entzündung oder Fibrose"[ii].
Schlussfolgerung
Viele Krebsarten "neigen dazu, invasiv und diffus zu wachsen und die angrenzenden, oft empfindlichen und anatomisch komplexen Strukturen zu infiltrieren".[i] FAPI-basierte Bildgebung und Radioligandentherapie werden einen Quantensprung in der krebsartübergreifende Nukleartheranostik darstellen. Es wird eine höhere Präzision in der Diagnostik und Behandlung vieler Krebsarten ermöglichen. Wissenschaftler konstruieren weiter am geeigneten Radiopharmakon, um die Aufnahme und Verweildauer zu optimieren. Testergebnisse mit einer Variante FAPI-46 waren ermutigend. Eine weitere neuartige Verbindung mit 2 Bindungsstellen hat ebenfalls vielversprechende Ergebnisse bei Patienten mit jodrefraktärem Schilddrüsenkrebs gezeigt und eine signifikant längere Retention von mehreren Tagen im Tumor und dessen Metastasen gezeigt. Dies sind nur die neuesten, aber sicher nicht die letzten Entwicklungsstufen. Bleiben Sie dran.
Endnoten
[i] Syed, M., Flechsig, P., Liermann, J. et al. Fibroblast activation protein inhibitor (FAPI) PET for diagnostics and advanced targeted radiotherapy in head and neck cancers. Eur J Nucl Med Mol Imaging 47, 2836–2845 (2020). https://doi.org/10.1007/s00259-020-04859-y
[ii] Calais, Jérémie. (2020). FAP: The Next Billion Dollar Nuclear Theranostics Target?. Journal of Nuclear Medicine. 61. jnumed.119.241232. 10.2967/jnumed.119.241232.
[iii] Ballal S, Yadav MP, Moon ES, Roesch F, Kumari S, Agarwal S, Tripathi M, Sahoo RK, Mangu BS, Tupalli A, Bal C. Novel Fibroblast Activation Protein Inhibitor-Based Targeted Theranostics for Radioiodine-Refractory Differentiated Thyroid Cancer Patients: A Pilot Study. Thyroid. 2022 Jan;32(1):65-77. doi: 10.1089/thy.2021.0412. Epub 2021 Dec 31. PMID: 34641705.
Figure 1 J Nucl Med 2019; 60:801–805, DOI: 10.2967/jnumed.119.227967
Bibliographie
Syed, M., Flechsig, P., Liermann, J. et al. Fibroblast activation protein inhibitor (FAPI) PET for diagnostics and advanced targeted radiotherapy in head and neck cancers. Eur J Nucl Med Mol Imaging 47, 2836–2845 (2020). https://doi.org/10.1007/s00259-020-04859-y
Kratochwil C, Flechsig P, Lindner T, Abderrahim L, Altmann A, Mier W, Adeberg S, Rathke H, Röhrich M, Winter H, Plinkert PK, Marme F, Lang M, Kauczor HU, Jäger D, Debus J, Haberkorn U, Giesel FL. 68Ga-FAPI PET/CT: Tracer Uptake in 28 Different Kinds of Cancer. J Nucl Med. 2019 Jun;60(6):801-805. doi: 10.2967/jnumed.119.227967. Epub 2019 Apr 6. PMID: 30954939; PMCID: PMC6581228
Giesel FL, Heussel CP, Lindner T, Röhrich M, Rathke H, Kauczor HU, Debus J, Haberkorn U, Kratochwil C. FAPI-PET/CT improves staging in a lung cancer patient with cerebral metastasis. Eur J Nucl Med Mol Imaging. 2019 Jul;46(8):1754-1755. doi: 10.1007/s00259-019-04346-z. Epub 2019 May 22. PMID: 31119317
Loktev A, Lindner T, Burger EM, Altmann A, Giesel F, Kratochwil C, Debus J, Marmé F, Jäger D, Mier W, Haberkorn U. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 2019 Oct;60(10):1421-1429. doi: 10.2967/jnumed.118.224469. Epub 2019 Mar 8. PMID: 30850501; PMCID: PMC6785792
Lindner T, Loktev A, Altmann A, Giesel F, Kratochwil C, Debus J, Jäger D, Mier W, Haberkorn U. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 2018 Sep;59(9):1415-1422. doi: 10.2967/jnumed.118.210443. Epub 2018 Apr 6. PMID: 29626119
Calais, Jérémie. (2020). FAP: The Next Billion Dollar Nuclear Theranostics Target?. Journal of Nuclear Medicine. 61. jnumed.119.241232. 10.2967/jnumed.119.241232
Ballal S, Yadav MP, Moon ES, Roesch F, Kumari S, Agarwal S, Tripathi M, Sahoo RK, Mangu BS, Tupalli A, Bal C. Novel Fibroblast Activation Protein Inhibitor-Based Targeted Theranostics for Radioiodine-Refractory Differentiated Thyroid Cancer Patients: A Pilot Study. Thyroid. 2022 Jan;32(1):65-77. doi: 10.1089/thy.2021.0412. Epub 2021 Dec 31. PMID: 34641705