Использование альфа-излучателей в радиофармацевтических препаратах для лечения рака
Использование альфа-излучателей в радиофармацевтических препаратах для лечения рака
В непрекращающейся борьбе с раком радиофармацевтика превратилась в мощное оружие, а альфа-излучатели, такие как актиний-225, астат-211 и свинец-212, быстро завоёвывают популярность. В лечении рака эти альфа-излучающие изотопы произвели революцию, так как таргетная терапия с их применением обладает потенциалом уничтожения злокачественных клеток, при этом сводя к минимуму повреждение окружающих здоровых тканей.
Альфа-излучатели: краткий обзор
Альфа-частицы состоят из двух протонов и двух нейтронов и несут в себе высокий заряд энергии. Эта высокая энергия и малый радиус действия (всего несколько диаметров клеток) превращают их в идеальное оружие для точного уничтожения раковых клеток. Эти характеристики позволяют вызвать двухцепочечный разрыв в ДНК, что наносит окончательный удар по раковым клеткам, в то же время сводя к минимуму сопутствующий ущерб соседним здоровым клеткам. Альфа-излучатель не вытеснит бета-излучатели, такие как лютеций, а скорее дополнит их, как Вы увидите ниже на примере 225Ac, используемого при лечении рака предстательной железы (РПЖ).
Актиний-225: точность в действии
Актиний-225 находится в авангарде исследований альфа-излучателей в применении к лечению рака. С периодом полураспада прибл. 10 дней, радиофармпрепараты (РФП), меченные актинием-225, показали превосходную эффективность при лечении метастатического рака, особенно РПЖ. Клинические испытания продемонстрировали значительное уменьшение опухоли и увеличение выживаемости у пациентов с запущенным РПЖ.
225Ac-PSMA в лечении рака предстательной железы
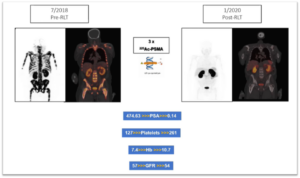
Особенно когда РПЖ уже метастазировал в костный мозг, альфа-излучатели могут идеально сочетаться с лютецием (бета-излучатель). Первый сеанс радиолигандной терапии, проводимый с использованием более мощного альфа-излучателя (например, 225Ac-ПСМА), позволяет уничтожить раковые клетки в костном мозге, не затрагивая при этом сам костный мозг. Это позволяет организму восстановить функцию кроветворения. Исследование, проведённое в Южной Африке, было первым, которое это продемонстрировало. Пациент с запущенным метастатическим РПЖ и значительной диффузной инфильтрацией костного мозга оправился от тяжёлой анемии после 2 сеансов 225Ac-ПСМА. Показатели гемоглобина и количество тромбоцитов резко улучшились, что в свою очередь, конечно, приводит к восстановлению врождённого иммунного ответа организма.
Мы предлагаем нашим пациентам с соответствующим профилем заболевания комбинированную терапию 1 + 2 (один сеанс 225Ac-ПСМА + два сеанса 177Lu-ПСМА).
225Ac-DOTATATE в лечении НЭО и менингиом
Лечение РПЖ радиофармпрепаратами в настоящее время является установившейся практикой из-за хорошо зарекомендовавшей себя эффективности. Между тем, универсальность актиния-225 позволяет конъюгировать его с различными другими молекулами, расширяя его потенциальное применение на другие виды рака, такие как нейроэндокринные опухоли (НЭО) и менингиомы.
Использование 177Lu-DOTATATE в лечении НЭО на самом деле предшествовало использованию 177Lu-ПСМА для терапии РПЖ. Тем не менее, опухоли могут иногда приобрести резистентность к лучевой терапии с более низким уровнем ЛПЭ (линейная передача энергии), например, с использованием бета-излучателей. Кроме того, некоторые агрессивные или запущенные формы могут не адекватно реагировать на бета-излучающую терапию. В таких случаях альфа-излучатели проявляют себя лучше из-за их большей цитотоксичности.
Открытие рецепторов DOTATATE на поверхности клеток менингиомы, распространённого вида опухоли головного мозга, стала ещё одним недавним прорывом. Учитывая сложную структуру мозга, где критичные структуры плотно обволакивают опухоли, точное нацеливание на опухоль с минимальным облучением окружающей здоровой мозговой ткани становится ключевым для смягчения побочных эффектов. Альфа-излучатели с их высококонцентрированной, но ограниченной в пространстве мощностью являются идеальным выбором.
225Ac-DOTATATE доступен в нашей клинике.
Астат-211: новый подход
Астат-211 является ещё одним перспективным альфа-излучателем, характеризующимся благоприятным периодом полураспада (7,2 часа) и мощным альфа-излучением. Короткий период полураспада гарантирует, что радиоактивный распад происходит в основном внутри опухоли, сводя к минимуму долгосрочное облучение пациента.
Астат-211 исследуется для лечения глиом, вида рака головного мозга с ограниченными терапевтическими возможностями. Исследователи разработали моноклональные антитела, меченные астатом-211, которые специфически нацелены на опухоль-ассоциированные антигены. Ранние фазы клинических испытаний показывают, что этот способ может доставить высокую дозу облучения в опухоль, пощадив при этом здоровую ткань мозга, что даёт надежду на улучшение результатов у пациентов с глиомой.
Lead-212: дуальная терапия
Свинец-212 выделяется своими уникальными свойствами распада, излучая как альфа-, так и бета-частицы. Такое дуальное облучение может быть полезным в определённых терапевтических контекстах. Альфа-частицы обеспечивают высокоэнергетическую цитотоксичность на коротком расстоянии, в то время как бета-частицы предлагают более широкий диапазон, потенциально нацеленный на микрометастазы.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) недавно присвоило 212Pb-DOTAMTATE статус «прорывной терапии» для лечения пациентов с запущенными гастроэнтеропанкреатическими нейроэндокринными опухолями (ГЭП-НЭО), экспрессирующими SSTR. Такое «обозначение пептида 212Pb-DOTAMTATE, нацеленного на рецепторы соматостатина SSTR, меченного свинцом-212, излучающим альфа-частицы, подтверждается клиническими испытаниями фазы 1 и протекающей фазы 2 (NCT05153772).»[2]
Свинец-212 также исследуется для использования в лечении рака яичников. Радиофармпрепарат 212Pb-TCMC-трастузумаб нацелен на рецептор HER2, гиперэкспрессируемый в злокачественных клетках некоторых видов рака яичников. Доклинические исследования на животных моделях показали, что это соединение может эффективно уменьшать опухоли и улучшать выживаемость. В настоящее время проводятся клинические испытания для оценки его безопасности и эффективности применения на людях.
Контроль над токсичностью
Несмотря на то, что альфа-излучатели обеспечивают точное нацеливание, их высокая энергия также может представлять опасность, если не контролировать её должным образом. Например, при лечении РПЖ избыточное облучение 225Ac-ПСМА имеет тенденцию повреждать слюнные железы (они, так же как и злокачественные клетки РПЖ, экспрессируют ферменты ПСМА), вызывая тяжёлую ксеростомию (сухость во рту), и побочные эффекты могут превысить преимущества. Одного начального сеанса 225Ac-ПСМА зачастую достаточно для достижения желаемого эффекта без повреждения слюнных желёз.
Будущее альфа-излучателей в терапии рака
Будущее альфа-излучателей в раковой терапии выглядит многообещающим, поскольку продолжающиеся исследования и клинические испытания прокладывают путь к новым парадигмам лечения. Интеграция передовых методов визуализации, таких как ПЭТ и ОФЭКТ, позволяет контролировать поглощение радиофармпрепаратов и терапевтический ответ в режиме реального времени. Эта обратная связь может быть использована для корректировки планов лечения и улучшения результатов.
Кроме того, изучаются подходы персонализированной медицины, при которых специфические генетические и молекулярные характеристики опухоли пациента используются для адаптации радиофармацевтической терапии. Такой подход к точной медицине имеет потенциал для дальнейшего повышения эффективности и безопасности терапии альфа-излучателями.
Заключение
Альфа-излучатели, такие как актиний-225, астат-211 и свинец-212, представляют собой значительный прогресс в радиофармацевтической области для лечения рака. Их способность доставлять высоконаправленные, смертельные дозы радиации к раковым клеткам является мощным инструментом в борьбе со злокачественными новообразованиями. По мере развития исследований и разрешения проблем эти альфа-излучающие РФП обещают улучшить выживаемость и качество жизни онкологических больных во всем мире.
[1] [225Ac]Ac-PSMA-617 α-radioligand therapy of patients with extensive skeletal metastases of castration-resistant prostate cancer, Sathekge et al. 2022
[2] "FDA Grants Breakthrough Therapy Designation to Novel Agent in GEP-NETs"
Библиография:
Matthew R. Griffiths, David A. Pattison, Melissa Latter, Kevin Kuan, Stephen Taylor, William Tieu, Thomas Kryza, Danielle Meyrick, Boon Quan Lee, Aaron Hansen, Stephen E. Rose, Simon G. Puttick First-in-Human 212Pb-PSMA–Targeted α-Therapy SPECT/CT Imaging in a Patient with Metastatic Castration-Resistant Prostate Cancer Journal of Nuclear Medicine Feb 2024, jnumed.123.267189; DOI: 10.2967/jnumed.123.267189
Albertsson P, Bäck T, Bergmark K, Hallqvist A, Johansson M, Aneheim E, Lindegren S, Timperanza C, Smerud K, Palm S. Astatine-211 based radionuclide therapy: Current clinical trial landscape. Front Med (Lausanne). 2023 Jan 6;9:1076210. doi: 10.3389/fmed.2022.1076210. PMID: 36687417; PMCID: PMC9859440.
Lawal IO, Morgenstern A, Vorster M, Knoesen O, Mahapane J, Hlongwa KN, Maserumule LC, Ndlovu H, Reed JD, Popoola GO, Mokoala KMG, Mdlophane A, Bruchertseifer F, Sathekge MM. Hematologic toxicity profile and efficacy of [225Ac]Ac-PSMA-617 α-radioligand therapy of patients with extensive skeletal metastases of castration-resistant prostate cancer. Eur J Nucl Med Mol Imaging. 2022 Aug;49(10):3581-3592. doi: 10.1007/s00259-022-05778-w. Epub 2022 Apr 6. PMID: 35384462.
Metebi A, Kauffman N, Xu L, Singh SK, Nayback C, Fan J, Johnson N, Diemer J, Grimm T, Zamiara M, Zinn KR. Pb-214/Bi-214-TCMC-Trastuzumab inhibited growth of ovarian cancer in preclinical mouse models. Front Chem. 2024 Jan 25;11:1322773. doi: 10.3389/fchem.2023.1322773. PMID: 38333550; PMCID: PMC10850308.
Video “Alpha is More Than Just Ac-225: Pb-212” JNM Podcast. Ken Herrmann, MD; David Bauer, PhD, from Memorial Sloan Kettering Cancer Center; Jane Sosabowski, BSc, MSc, PhD, from Queen Mary, University of London; Nick Fletcher, PhD, from the University of Queensland, Australia.
Demirci E, Alan Selçuk N, Beydağı G, Ocak M, Toklu T, Akçay K, Kabasakal L. Initial Findings on the Use of [225Ac]Ac-DOTATATE Therapy as a Theranostic Application in Patients with Neuroendocrine Tumors. Mol Imaging Radionucl Ther. 2023 Oct 20;32(3):226-232. doi: 10.4274/mirt.galenos.2023.38258. PMID: 37870290; PMCID: PMC10600558.
Stallons TAR, Saidi A, Tworowska I, Delpassand ES, Torgue JJ. Preclinical Investigation of 212Pb-DOTAMTATE for Peptide Receptor Radionuclide Therapy in a Neuroendocrine Tumor Model. Mol Cancer Ther. 2019 May;18(5):1012-1021. doi: 10.1158/1535-7163.MCT-18-1103. Epub 2019 Mar 29. PMID: 30926632; PMCID: PMC6497546.
Sabrina Serani, February 12, 2024, FDA Grants Breakthrough Therapy Designation to Novel Agent in GEP-NETs, retrieved 03.06.2024 from https://www.targetedonc.com/view/fda-grants-breakthrough-therapy-designation-to-novel-agent-in-gep-nets